出品 | 虎嗅医疗组
| 陈广晶
| 王一鹏
头图 | 视觉中国
中国新药杀疯了。
“11:0全票通过!”美国FDA肿瘤药物咨询委员会(ODAC)全票认可了西达基奥仑赛安全有效性评估结果,北京时间3月16日凌晨3点50分,传奇生物通过官方微信公众号第一时间分享了这一喜讯。
全票通过的结果,不仅意味着,西达基奥仑赛或将很快获批用于多发性骨髓瘤成年患者的早期治疗,更意味着,笼罩在其头上的安全性疑云正在消散,对于进一步的市场扩大是双重利好。
作为中国自主研发并成功出海的第二款药物、中国企业自主研发的第一款CAR-T产品,西达基奥仑赛表现出了惊人的商业化潜力。2023年,西达基奥仑赛全年销售收入已经突破了5亿美元(约36亿元人民币),这使传奇生物的外部收入达到2.85亿美元,同比增长144.2%!
更重要的是,这款药在美国获批上市才两年。要知道,全球首款CAR-T产品诺华的Kymriah,上市第四年才到这个水平。
按照合作开发美国市场的跨国巨头强生预测,该药今年销售收入就可以突破10亿美元,其巅峰收入可以达到50亿美元——这将是继百济神州的泽布替尼之后,第二个年销过10亿美元的国产新药。
自2018年起,商业化问题就扼住了产业发展的咽喉,业界甚至流传着“中国创新药不上市还好,一旦上市就没戏可唱”的说法。言外之意是,一款药没上市之前还有市场空间可以想象,一旦上市,赤裸裸的财务数据就会彻底暴露他们在商业化上的无能为力。
因此,西达基奥仑赛、泽布替尼在美国大卖,对于仍在死亡边缘挣扎的中国创新药企,乃至整个产业来说,都是一针“强心剂”。出海美国,此刻已经真正成为中国药企的“速效救心丸”。
新药旧出海路走到了尽头
传奇生物的成功,很关键的一点,在于选对了合作伙伴。实际上在2017年,西达基奥仑赛的临床数据亮相时,就惊艳了全场——9名患者100%“治愈”,让很多大公司的BD都想与之合作。最后还是强生抢占了先机。后来的事实证明,对于双方而言,这是双赢的选择。
传奇生物相关负责人表示,强生在国际化、产品开发、申报、注册、商业化中,都给到传奇生物以资源支持。也有多位行业人士曾向虎嗅强调,西达基奥仑赛之所以成功,很重要的一点是试验设计优秀,这对产品后期的更多适应症开发,持续延长生命力等都非常重要,同时也是强生的强项之一。
据传奇生物相关负责人介绍,其中一个成功的设计点,就是在美国入组患者时,慎重考虑人种问题。“美国 FDA 要求,在美国申请上市的临床试验数据需要对相应人群有适用性,如果用 100%亚裔人群或者仅仅在国内做的试验数据报批是比较困难的。”
不要小看这个坑,多年以后(2022年初),信达生物就在这里栽了跟头,他们的信迪利单抗,因此错失了作为国产PD-1,第一个进入美国市场的机会。
巧合的是,另外一个关于试验设计的经典案例,也是关于PD-1的——说的是PD-1的两个先驱——百时美施贵宝的O药(Opdivo,纳武利尤单抗)和默沙东的K药(Keytruda,帕博利珠单抗)。
当年O药是首个上市的PD-1,凭借先发优势把K药远远甩在后面,但是,在非常关键的肺癌适应症开发上意外失利,结果让K药后来居上,一举扭转了战局。现在O药的年销售额虽然也在全球TOP10之内,但K药却已成为新一代“药王”了。
2017年时在强生做副总裁的申华琼女士,在一次公开的行业活动中,分析过这个案例,她说,默沙东之所以成功,很关键的一点,就是在试验设计中加入了“患者肿瘤的PD-L1阳性水平>50%”这个条件。
但是,从目前情况看,想要找到好的合作伙伴越来越难了。
在中国新药对外许可(license-out)的热潮中,跨国药企“退货”的消息层出不穷。据不完全统计,2022年以来,至少已有21起“退货”事件了。较早“借船”的恒瑞医药、君实生物、信达生物、基石药业等,都成了“受害者”。
造成“退货”的原因虽然是复合的,但海外合作方“自身难保”的情况,显然让问题变得更加严重。比如:百济神州的替雷利珠单抗去年被合作伙伴诺华“退货”时,双方给出的理由就是“基于战略和财务考量”。翻译过来,就是跨国大佬也缺钱了。
全球医药市场环境已经发生了巨大的变化。随着重磅炸弹(年销超过10亿美元的药品)陆续失去专利保护,各大跨国药企业绩压力也越来越大,为了稳住市场表现和投资信心、保住岗位、不降薪,几乎成了各大药企首席执行官(CEO)最为头疼的问题。
在这种情况下,跨国巨头们不免动作变形,甚至会像“无头的苍蝇”般毫无章法。从表现上看,就是一边疯狂并购、买入管线,一边裁员、退货、卖产业。
即便没有退货,大药企手里的在研管线太多,中国新药处于弱势地位,能否受到“重用”也很难说。更令人心痛的是,很多中国管线还是“青苗”,就被“贱卖”了,一不小心就成了跨国药企的探路石。
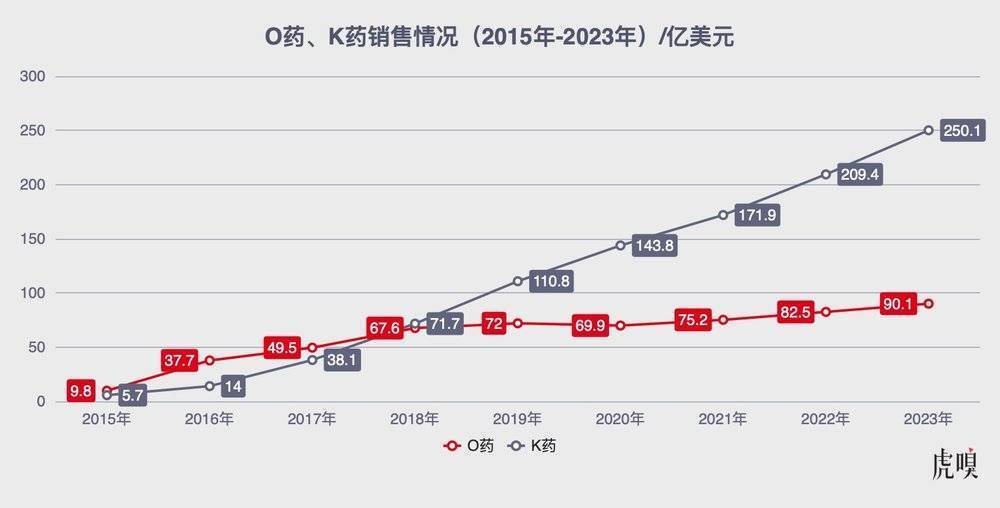
O药、K药这些年“打擂”的情况,数据来自公开资料/虎嗅制图
国产药前所未有的机遇
合作伙伴层面的匮乏、药明系公司在美国的遭遇,让很多人对创新药失去信心,但从美国监管方的实际行动看,美国还是非常需要中国新药的,最明显的标志是,中国新药也正在批量敲开美国药品监管的大门。
今年3月以来,贝达药业的恩沙替尼(小分子靶向药),百济神州的替雷利珠单抗(PD-1抑制剂)相继获FDA批准。加上去年获批的4款新药,一年多的时间,美国已经批了6款中国新药,比此前三四年批准中国新药的总和还高出了50%。
背后的原因是多方面的。
首先,相比其他产业,医药关乎生死,是少有的可以超越国界、穿越周期的产业,尽管也被地缘政治波及到,但是只要美国患者有需要,政府部门也很难真正限制。
第二,业界认为,美国近期一系列操作主要是让产业链回归,对创新药产品审批影响不大。
第三,中国新药也在美国规则下,证明了自身实力。
比如:君实生物的特瑞普利单抗,作为第一个在美国获批的国产PD-1,是美国首个鼻咽癌治疗药物;
百济神州的替雷利珠单抗解决了食管鳞状细胞癌转移后无药可用的问题;
和黄医药的呋喹替尼是“美国首个且唯一用于治疗经治转移性结直肠癌的针对全部三种VEGF受体激酶的高选择性抑制剂”。
此外,还有一个重要的原因,就是美国医药市场也发生了改变,性价比高的中国新药正是“香饽饽”。
医疗费用对各国支付体系来说都是巨大的压力,对美国更加如此。美国医药领域的规则,一贯是鼓励首创(First-in-class),以往几乎是只有前三个上市的新药才能得到丰厚的回报。但是随着生物药逐渐占据市场主导,这样的体系将医疗费用越推越高。
一项数据显示,仅2012年到2018年的6年间,美国生物药市场规模就增长了约1700%,到2023年已经增长到了7000亿美元。生物药在其医药市场整体销售额中已经占到了51%,所服务人群却是还非常有限。
这让一贯“不差钱”的美国也感到吃不消,开始寻求降药价了。按照市场逻辑,更多新药加入竞争,会增加医生的选择,也会促进价格竞争。因此,2021年以来,创新药的“平替”产品(一般来说是生物类似药,也就是生物药中的“仿制药”)越来越受重视。连2022年通过的《通货膨胀减少法案(IRA)》中都有涉及。
2023年以来,FDA批准这类药品的速度似乎加快了。根据三星生物今年1月发布的一份报告,截至今年1月份,FDA一共批45个生物类似药,涉及14个品种。别的不说,光中国PD-1就批了两个。
严格来说,中国的新药并非常规意义上生物类似药,不过,由于过去几年疯狂内卷,硬生生做成了“仿制药”。至少在当下,行业专家认为,中国新药借助生物类似药爆发式发展的热潮,通过顺利进入美国市场来打开商业化局面,是非常有可能的。这也是中国新药批量进入美国市场的机遇期。
2023年在各种负面消息中,药明康德的业绩首次突破了400亿元,其中65%来自美国。按照该公司预期明年他们从美国获取的收入还会在211亿元以上。无论他们是否过于乐观,一个客观事实是,美国创新药企需要中国的“工程师红利”,美国医疗体系需要中国新药。
在硬币的另一面,中国企业也不应该放弃美国这个大市场。
北京药眼/慧药咨询创始人魏利军曾在撰文中透露,未来几年将是生物类似药发展的黄金时期,其市场规模到2030年将达到1300亿美元。其中的30%到40%还是会在美国。届时仍然是“得美国市场者得天下”。
为了降低处方药的生产成本,缓解药品短缺,美国的医疗中心都办过仿制药厂。
来自:视觉中国
抱团出海也许是最佳选择
“国内药企,是时候放下隔阂、改变战略、抱团取暖了。”早在2023年海外退货较多时,南京应诺医药科技有限责任公司董事长郑维义博士就曾向虎嗅这样表示。
传奇生物相关负责人告诉虎嗅,药企出海不是一个短期行为,从寻找合作伙伴开展全球临床试验,到进入注册阶段,然后到GMP生产等等,是一个长达数年的过程,需要耗费大量的资金,因此企业需要制定长期的融资计划,才能够满足新药开发这样一个周期长、风险高、投入大的需求。
可见过程之艰辛。这样艰辛的过程中,除了资金,也必须有合有力的支撑才行。
从历史经验来看,传奇生物并不是石头缝里蹦出来的,它在知名CRO公司金斯瑞平台孵化而来。创立之初,没有启动资金、没有知识产权,连实验设备和办公产地都是金斯瑞提供的,初创团队只有9个人。
这样的团队敢挑战当时最难的赛道,除了团队成员有实力之外,金斯瑞也给出了很多支持。根据《经济观察报》等媒体报道,传奇生物到国际市场申报的过程中,一直有金斯瑞的商务拓展(简称:BD)陪同,到美国考察更是有北美BD同事接应。
正因为此,西达基奥仑赛才能早早就在美国申请了临床试验,这也是后来顺利与强生合作的基础。
对于新药中的后起之秀,跨国大药企靠不住,本土药企也不失为好的选择。
事实上,过去几年为了出海,很多老牌传统药企、发展较为成熟的国内创新药企,也都在“硬件”上做了很多准备。
比如百济神州,根据该公司总裁吴晓滨接受媒体采访时所说,他们已经在全球建立起了3700人以上的商业化团队,其中约300人在北美,200人在欧洲。在与强生合作中,传奇生物的产品销售也并非全部依靠合作方,也有自建的团队。
国内的老牌巨头恒瑞医药、复星医药、中国生物制药等,也都在海外开拓了业务,通过自建、收购等方式,具备了一定的研发或商业化的能力。
而且很多企业也表现出了成为中国创新药出海的桥梁和纽带的意愿。
就在3月5日,百济神州刚刚发布公告称,要将其全资子公司Pi Health,Ltd.拆分出来,引入外部投资人共同推进其在医疗健康行业的软件开发、分析和研究解决方案做进一步的经营。
这家公司估值4179.84万美元(折合人民币约3亿元),原本是百济神州2021年建立用来加强该公司数据分析和临床研究能力的。这些业务本身就带有CRO的意味,因此,此次拆分被认为是百济神州剥离出了一家CRO公司。
客观来说,这些机构、人员已经存在,更多产品加入不仅可以分摊成本还有助于开拓市场。百济神州需要更多的新适应症和产品加入进来,以将其商业化潜力充分释放出来。
正因为此,百济神州也在逆向重金引入(license-in)新的管线。这项2023年完成的价值13.3亿美元交易,直接推高了当年国内license-in的总规模。
不得不面对的现实是,随着医药行业进入资本寒冬,资本对企业的评价标准从原来的看中管线潜力转为赚钱的能力。类似百济神州、传奇生物虽然业绩增长很快,但是仍然处于亏损的状态。通过各种渠道扭亏、持续缩小亏损越来越重要了。
国内药企在过去的合作中,确实发生过一些不愉快,当下哪些企业能率先放下隔阂,或许就已占领了先机。
结论。